时间:2022-12-04 22:59
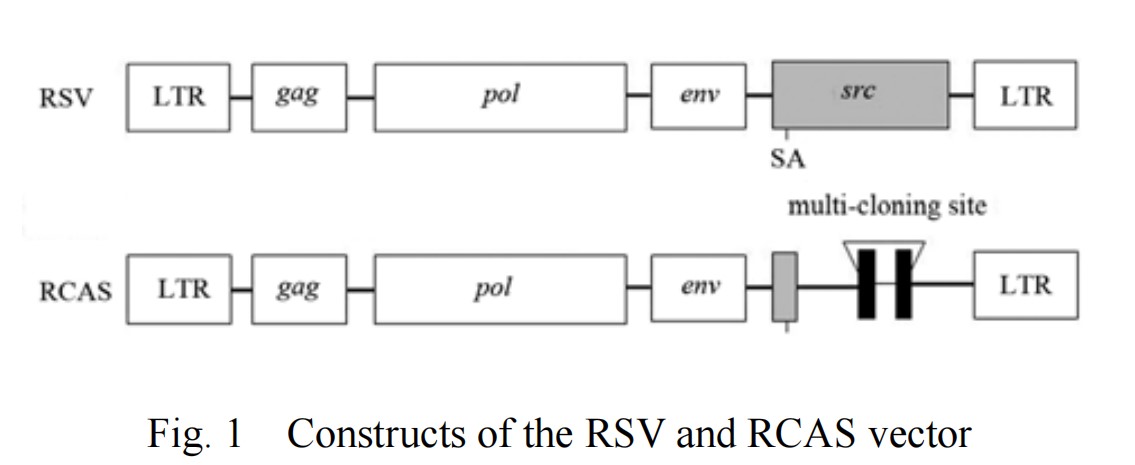
· RCAS-TVA系统原理 ·
RCAS-TVA基因递送系统的基础是RCAS病毒特异性识别禽肉瘤白血病病毒亚组A(ASLV-A)受体(TVA),进入并感染细胞。TVA是低密度脂蛋白受体家族一员,由tv-a基因编码。tv-a基因转录的mRNA被选择性剪接产生至少两种蛋白质,一种跨膜蛋白和一种GPI-锚定亚型,均能被ASLV-A识别。哺乳动物细胞缺乏编码TVA的基因,通常对ASLV-A或RCAS病毒感染具有抵抗力;然而,将TVA转基因靶向特定类型细胞或小鼠组织可使这些细胞易受到基于ASLV-A的RCAS病毒感染。
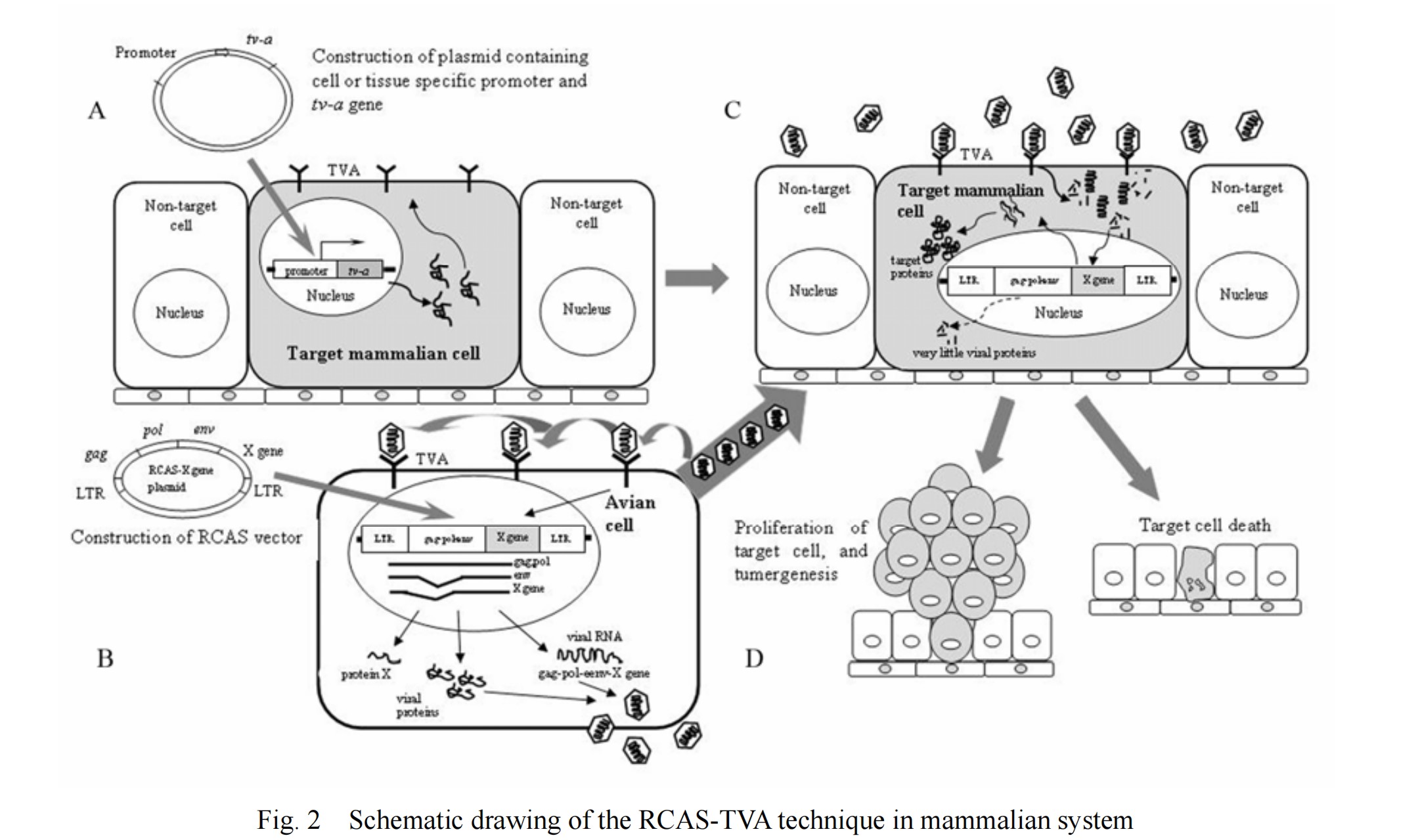
图2 哺乳动物中RCAS-TVA技术示意图
· RCAS-TVA系统的优缺点 ·
1、RCAS-TVA 系统是一种成本低、简单且高效的方法,可以利用单个TVA小鼠品系同时研究多个基因的生物学功能,如多个基因对肿瘤发生的影响;而不需要通过传统的转基因/敲除/敲入方法或多轮杂交等将每个感兴趣基因生成一个小鼠品系。例如,在elastase启动子介导TVA表达的小鼠品系中,可利用RCAS-c-myc或RCAS-PyMT的传递,诱导三种不同的胰腺肿瘤类型,也反映了胰腺中的三种主要细胞系[2]。
2、RCAS-TVA系统可通过TVA靶向特定细胞类型,并通过RCAS病毒的定时传递,对基因表达进行时间和空间的调控。这一点对利用小鼠模型模拟人类癌症非常重要。人类癌症几乎普遍发生于获得多重基因撞击的单细胞群体。这些细胞克隆在物理上彼此分离,并被正常细胞包围。因此,对这种情况进行建模以了解癌细胞如何与周围的正常细胞和微环境进行通信,以及癌细胞克隆如何为了自身的生长优势而危及其周围的正常细胞和/或微环境非常重要。
大多数人类癌症属于衰老疾病,因此理想情况下以可控的方式,在成年小鼠中模拟癌症至关重要。如针对乳腺肿瘤的一系列研究为利用RCAS-TVA系统在时空调控基因表达提供了一个很好的例子。MMTV-TVA转基因小鼠在乳腺管上皮中表达TVA,通过乳头导管将表达多瘤病毒T抗原(PyMT)的RCAS病毒注射到乳腺,可诱发乳腺肿瘤[3]。如怀孕对人类乳腺癌的影响,在交配前4-7天,通过导管内注射RCAS-caErbB2病毒转染MMTV-tva小鼠,这种乳腺癌在人类妊娠期间或分娩后5年内被才诊断出来[4]。
3、尽管使用RCAS-TVA基因递送系统模拟小鼠人类癌症具有明显的优势,但也存在一定的局限性。首先RCAS病毒容量有限,允许插入片段的大小约3 kb ,片段过大,可能会造成病毒插入片段丢失、截断或病毒产量降低。另一个限制是RCAS病毒只在细胞分裂状态时才能将病毒cDNA整合到宿主基因组中,这极大地限制了在成人组织中感染的细胞数量,并且通过选择性地感染分裂细胞可能会产生人为效应,这些分裂细胞可能无法完全代表其他静止细胞的特性。目前也研发有一种ALSV- A伪型慢病毒,以慢病毒系统感染难以靶向的细胞类型和组织[5]。
· 总结 ·
RCAS-TVA系统为研究人类癌症小鼠模型中的基因功能提供了一种简单快速的方法。这些模型为特定肿瘤的起源细胞以及起始遗传病变在决定肿瘤类型中的作用提供了重要的见解。RCAS-TVA模型可与现有的转基因、敲除或敲入模型的结合,为扩展这些模型的效用提供了机会。
上述产品/服务布林凯斯均可提供
快来联系小布吧
本文未经授权禁止转载
如有需要,可联系小编获取原文
1)Ahronian L G, Lewis B C. Using the RCAS-TVA system to model human cancer in mice[J]. Cold Spring Harbor Protocols, 2014, 2014(11): pdb. top069831.
2)Lewis B C, Klimstra D S, Varmus H E. The c-myc and PyMT oncogenes induce different tumor types in a somatic mouse model for pancreatic cancer[J]. Genes & development, 2003, 17(24): 3127-3138.
3)Holloway K R, Sinha V C, Toneff M J, et al. Krt6a-positive mammary epithelial progenitors are not at increased vulnerability to tumorigenesis initiated by ErbB2[J]. PLoS One, 2015, 10(1): e0117239.
4)Haricharan S, Hein S M, Dong J, et al. Contribution of an alveolar cell of origin to the high-grade malignant phenotype of pregnancy-associated breast cancer[J]. Oncogene, 2014, 33(50): 5729-5739.
5)Lewis B C, Chinnasamy N, Morgan R A, et al. Development of an avian leukosis-sarcoma virus subgroup A pseudotyped lentiviral vector[J]. Journal of virology, 2001, 75(19): 9339-9344.
