时间:2022-03-31 16:38
现代神经科学研究的核心在于破译人类思维的神经机制和过程。这一目标的实现需借助于能够在细胞和环路层⾯记录和刺激神经通路的神经科学技术。研发用于监测自由活动的动物脑组织的微型双向神经接口有重要意义。
2020年12⽉发表在《Nature Neuroscience》上的⼀篇综述(PMID: 33199897),介绍了目前基于电学、光学和微流体神经接口的神经科学技术,结合遗传学的应用,目前已形成多样化的神经科学研究平台,具体表现在三个方面(图1):1)⼯程组件,也就是设备的多样化,包括柔性可拉伸的透明材料,多路复用光波导,微型无机物发光源和检测器、小型化、无线及无电池技术;2)神经技术平台,包括优化的电极、光学探针、微流控探针和微型显微镜;3)神经科学方法,包括电生理学、药理学、光遗传学以及光电传感器等。
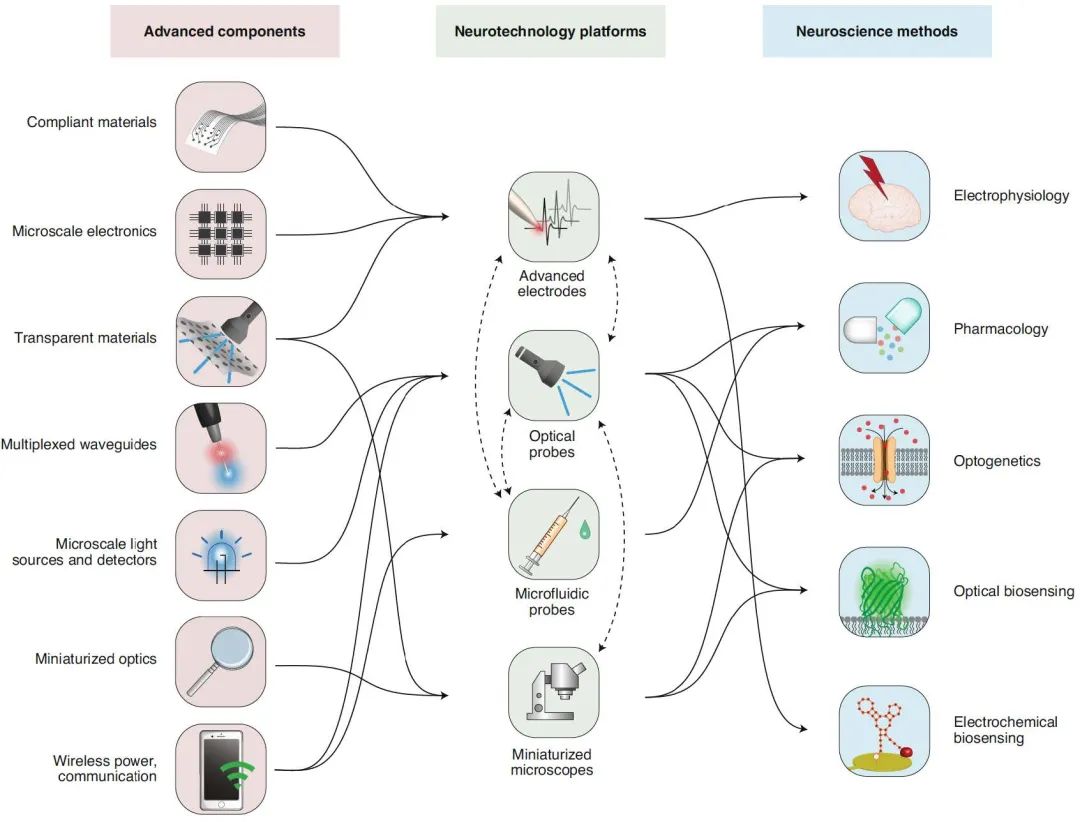
图1 | 神经工程学和神经技术平台的发展为神经技术的多样化奠定了基础
1►
电刺激和记录平台
传统的电接口依赖于电极探针或柔性电极片,尺寸较大,记录和刺激的时空范围有限,大多数技术采⽤相对简单的布局、⾮理想集合形状和机械性能,导致其无法获取高分辨率映射功能或互补接口。大多数传统电子材料(钨,~200 GPa;硅,~150 GPa)和神经组织(~1-10 kPa)的模量之间的巨⼤失配会导致集成和后续使用过程中的物理损伤,进⽽引发炎症等。因此利用神经⼯程学,以研发⾼组织相容性、低弯曲刚度、超小型化的薄、软的电极材料,实现单细胞分辨率的刺激和记录。
1、材料方面,通过纳米结构增加电化学表面积,聚合物和纳米符合材料的混合传导机制(离子-电子)至关重要。目前已有聚3,4-乙烯二氧噻吩:聚苯乙烯磺酸盐(PEDOT:PSS凝胶,图2a),镀金二氧化钛纳米线(Ay-TiO2, 图2b),铂-硅复合物(图 2c)及导电聚合物聚吡咯/聚⼰内酯嵌段聚四氢呋喃嵌段聚己内酯薄膜(图2d)。上述材料具有低阻抗、高电荷注入能力(CICs)的特点,与水凝胶或弹性薄膜结合,可形成柔软、高组织相容性的神经接口。
2、半导体中使用的微型和纳米制造技术可以用于生产高密度电极阵列。例如,1)256阵列的铂金电极(图2e)可用于大鼠新生皮层和海马、癫痫手术治疗患者的颞中回的动作电位的记录;2)在300x300 μm2的聚酰亚胺薄膜上,包含了360个记录位点,每个通道可在皮层进行277 kHz的采样(图2f);3)在柔性基板(195x270 μm2)分布1008个电容耦合电极,可在1-2cm2范围内进行每通道781.25 Hz频率的电信号采集(图2h);4)基于晶圆的互补金属氧化物集成电路技术,960个氧化钛电极排列在硅探针(12x2 μm)中,探针横截面有70x20 μm2,采样频率可达每通道30 kHz。
3、透明导体的开发,以允许同时使用光遗传学、荧光宽视场显微镜和双光子显微镜。如氧化铟锡(直径200 μm,厚度0.1 μm, 图2i),单层或多层石墨烯(每层直径110 μm,厚度0.3 μm, 图2j),光学透射率分别为 70% 和 90%,薄层电阻为12 Ω/sq和76 Ω/sq,和接口阻抗分别为 1.6 Ωcm2和 19 Ωcm2。氧化锌基透明电极阵列(长 1.5 mm,间距 0.4 mm,底径 125 μm)以聚对⼆甲苯 C(折射率 ~1.6)作为涂层,深度可达大脑 1.5 mm。也有用细网格导电膜结构的六角孔薄膜(图2k)和方形网格(图2I),透光率分别为70 %和60 %,接口阻抗为1.63 Ωμm2 和0.14 Ωμm2。
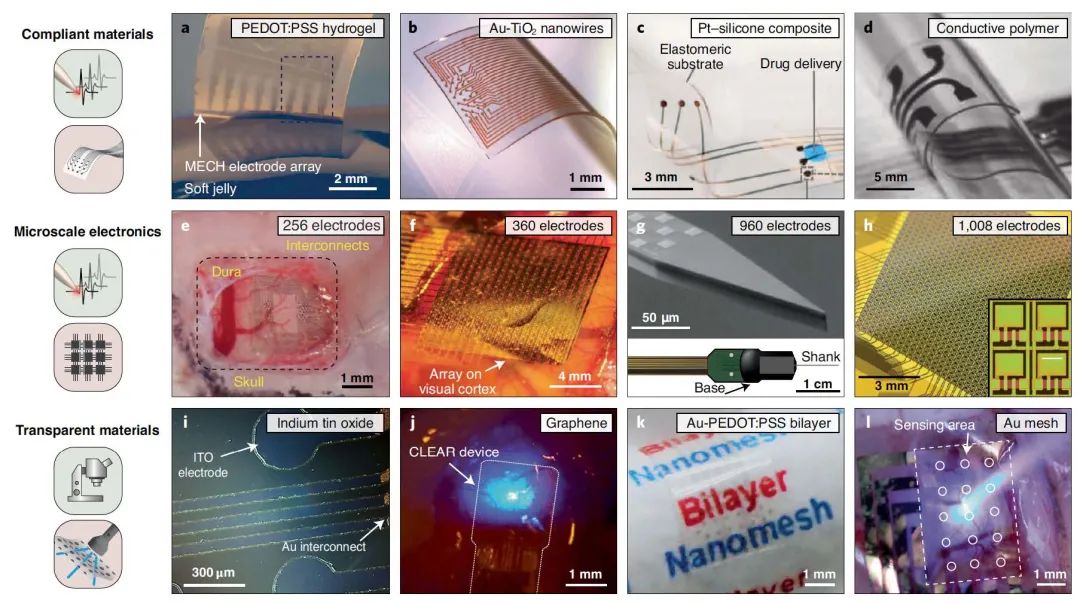
图2 | 用于电记录和刺激的神经接口和材料
利用NeuroGrid的64通道电极记录大鼠体感皮层神经元活动,发现皮层神经元的放电率在低频θ振荡谷处降低,并且这些速率与睡眠纺锤波锁相。这种同步的、突触耦合的神经元活动是非快速眼动期(NREM)睡眠状态的特征。此外,从癫痫患者手术期间获得的微皮质脑电图数据提示,局部神经元活动功能障碍可产生与癫痫临床症状。
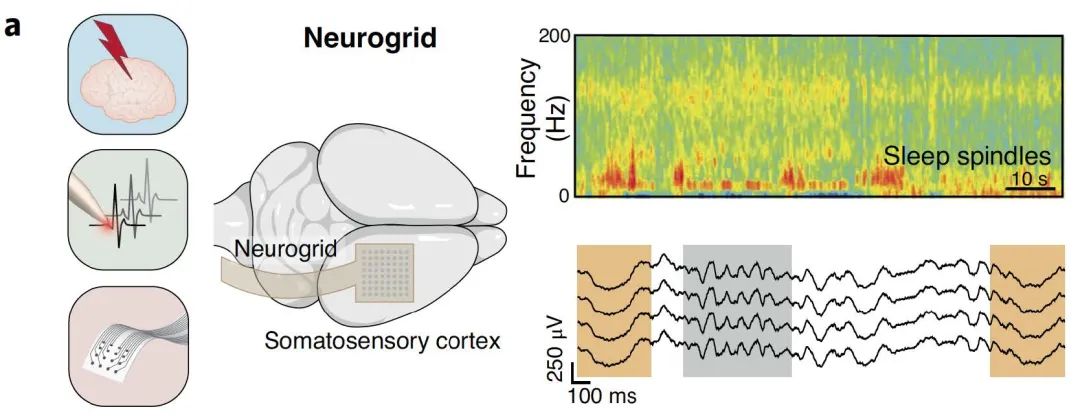
图3 | 大鼠体感皮层神经元活动与睡眠相关性
高密度、大面积的监测系统使我们能够监测局部神经元以及整个大脑神经群的活动。NHP 模型中高分辨率及多区域跨度记录神经元活动,发现导致计划和执行的视觉刺激存在远程相互作用。
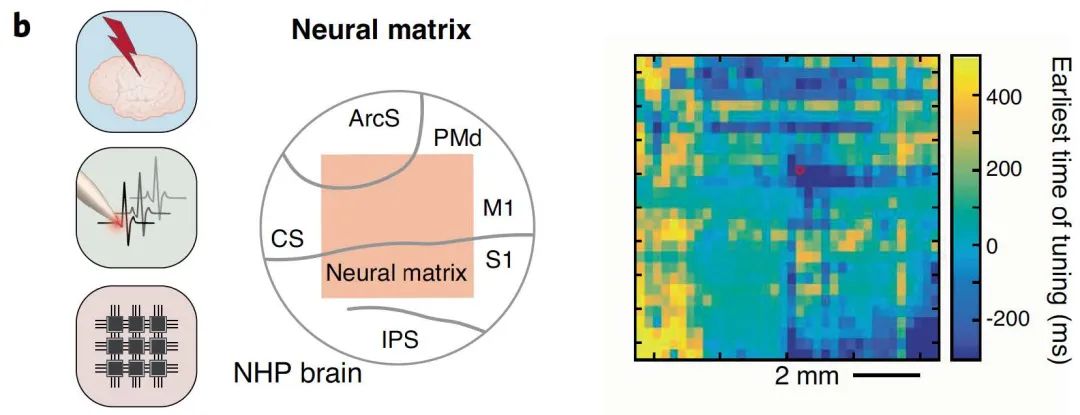
图4 | 高分辨率及多区域跨度的神经元活动记录
最近的实验表明,使用GCaMP进行单神经元TPM Ca2+成像,可以捕获初级视觉的宽频带以上的电生理信号。因此,单神经元Ca2+信号的增加所导致的α到超高γ波段的神经元活动增强与和相应的瞳孔扩张行为相关,可能可作为唤醒增加的证据。
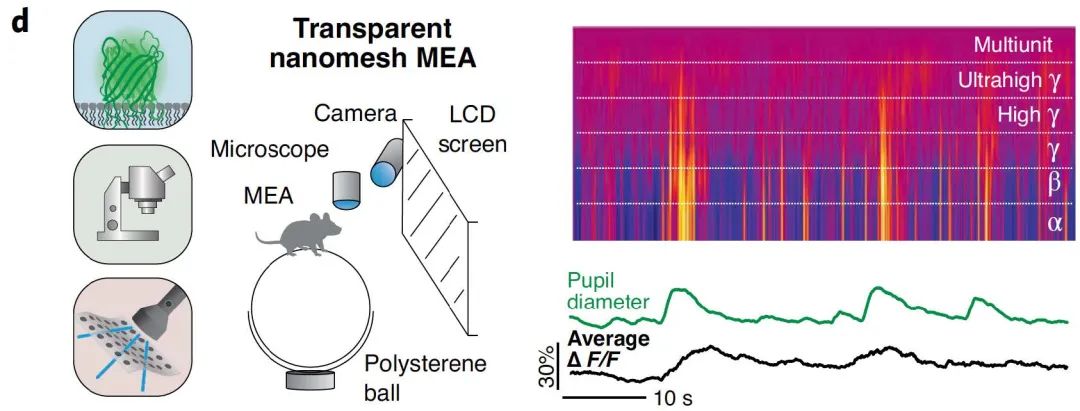
图5 | 单神经元TPM Ca2+成像揭示神经元活动与行为相关性
2►
光刺激和记录平台
通常的测光(phtometry)使用标准光纤电缆进行光遗传学和局部荧光测量的方法。应用在动物实验的问题在于,光源和/或探测器之间的连接、高模量玻璃的波导(~50–90 GPa)与神经软组织(~1–10 GPa)的耦合不理想,光探测和传输的选择受限。
结构化和锥形纤维 (TF)可通过多波长体积或多点照明和收集,来检测大型、选择性的神经元群。多模光纤还可以从尖端的小锥角 (~3–6°) 进行多路分解 (MDD),这也可以最大限度地减少组织损伤。在光纤后端选择性激发的不同波导模式在锥形的不同部分折射出,以支持大脑不同深度的选择性多波长照明。
图 3a 显示了⼀个具有代表性的多点发射光纤,它使用 MDD将光刺激传递到七个不同的发射窗口(~20 μm)。这些窗口还可以选择性地收集荧光信号,以允许在单根光纤中进行空间分辨的光遗传学刺激和光度测定。另一种方法是依靠平面波导,光刻定义在扁平硅柄(厚<50 μm)上,以及波分多路分解(WDD)技术,将光引导到多个蜂窝级外耦合照明区域(图3b)。
其他类型的探针通过使用微型无机发光二极管 (μ-ILED) 作为组织嵌入的照明源消除了对系留光波导的需求,该照明源还可以支持用于传感和/或其他形式的神经调节的组件。图3c展示了硅探针(70 μmx30 μmx5 mm)包括小型氮化铟镓 μ-ILED(10×15 μm2)阵列,以单神经元分辨率向⼤脑中的目标位置提供光源 ,强度高达~350 mW/mm2。一组原理类似的钛铱电极(11×13 μm2,阻抗 1.43 Ωcm2)提供同时电生理记录功能。图 3d 展示了聚酯灯丝(20 μm)用作四个 μ-ILED 的基板(50 × 50 μm2,6.45 μm厚),每个Led可产生高达 40 mW/mm2 的强度。在多层配置中添加微型无机光电探测器(μ-IPD;200×200 μm2,1.25 μm厚)、薄膜 Pt 电极和温度传感器可实现多模式操作,同时探针尺寸的增加最小(图3e) ,用于全面监测神经活动和对光刺激的反应。
另外,这些组件支持射频共振无线传输,可用于研究自由移动的个体。事实上,最先进的系统(图 3f)可以以薄膜(~500 μm)的形式进行皮下植入,可在体内工作多年,并不会对动物的运动或神经系统产生影响。图4h示意了⼀个用户控制的无线双向通信的传感器,包括一个μ-ILED和一个μ-IPD,以分别刺激和记录与探针附近的钙指示剂相关的荧光信号。微控制器 (3×3 mm2) 同步刺激和记录,并使⽤红外光通信链路在大鼠中进行27 Hz采样和12位精度的无线数据传输。这种小型化系统可作为皮下植入物,不仅用于钙记录,还可用于监测由基因编码的FL探针转导的其他神经化学动力学,可用于局部测量神经组织中的血氧。

图6 | 光刺激、记录及成像的脑机接口
一项研究利用TF的多点照明,对小鼠腹侧和背侧纹状体之间的投射神经元进行动态光学刺激,以观察它们对运动的影响。同时刺激腹侧和背侧纹状体导致运动减少并触发逆时针转动,而仅刺激腹侧导致行进距离显着减少。
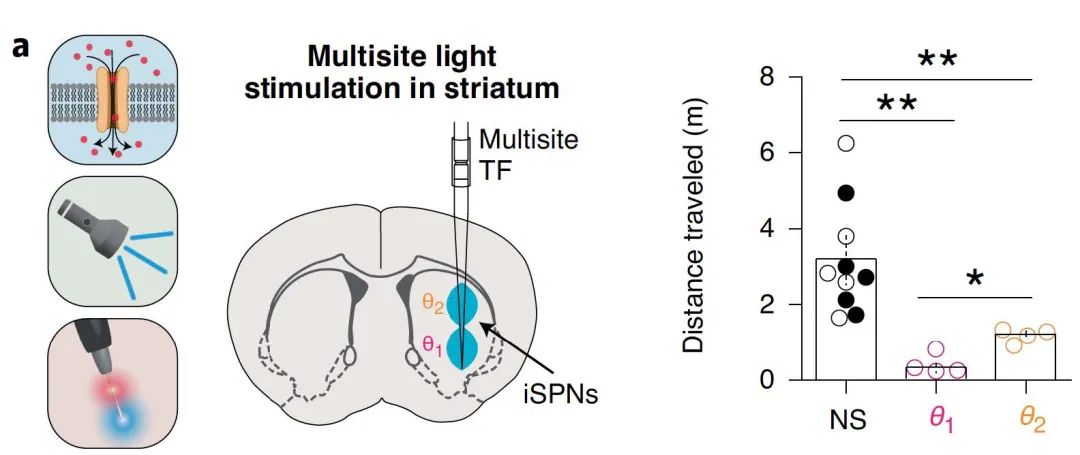
图7 | TF的多点照明观察行为变化
也有研究将μ-ILED与微电极相结合,对少量锥体细胞进行光激活,并同时测量海马网络中周围中间神经元的动作电位,以观察单突触之间的相互作用。
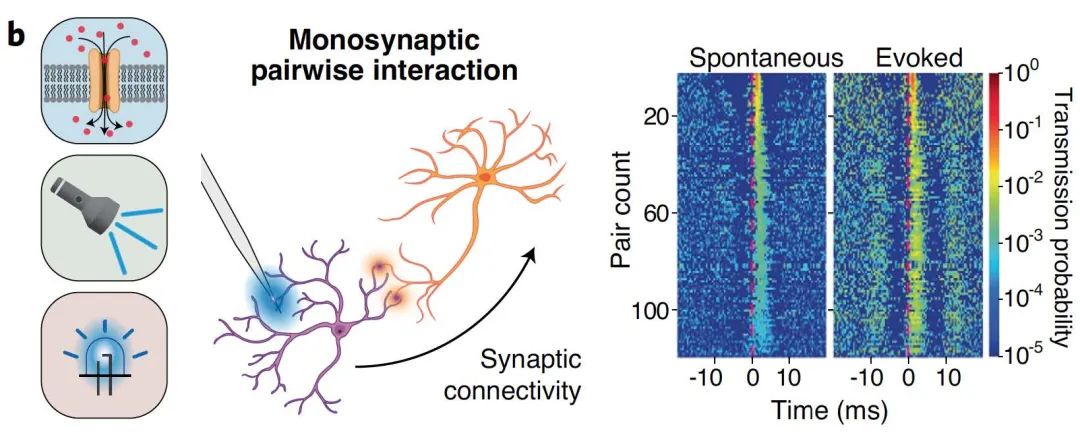
图8 | μ-ILED与微电极相结合观察单突触相互作用
可植入、无线、无电池平台使科研人员能在自由行为中进行刺激和记录。一项研究探讨了通过光激发小鼠L4-L6脊髓节段的瞬时受体电位香草素 1 (TRPV1) 传入神经来调节伤害行为。光激活产生可逆的疼痛行为,提示了这些传入神经的作用和机制。
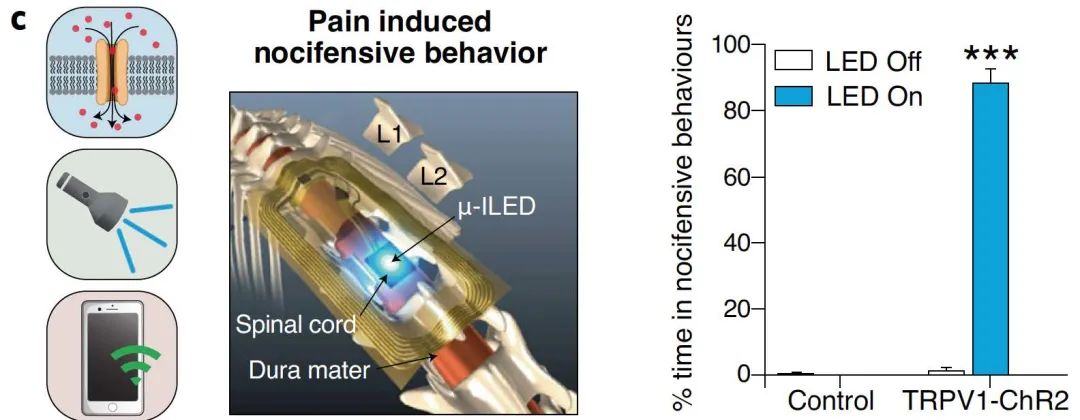
图9 | 植入性无线平台记录神经行为调节
还有研究观察了意外足部休克期间小鼠基底外侧杏仁核 (BLA) 中的Ca2+信号变化。电击后Ca2+峰值的频率显着增加表明BLA中的神经元活动与恐惧和焦虑等负面情绪之间存在很强的相关性。
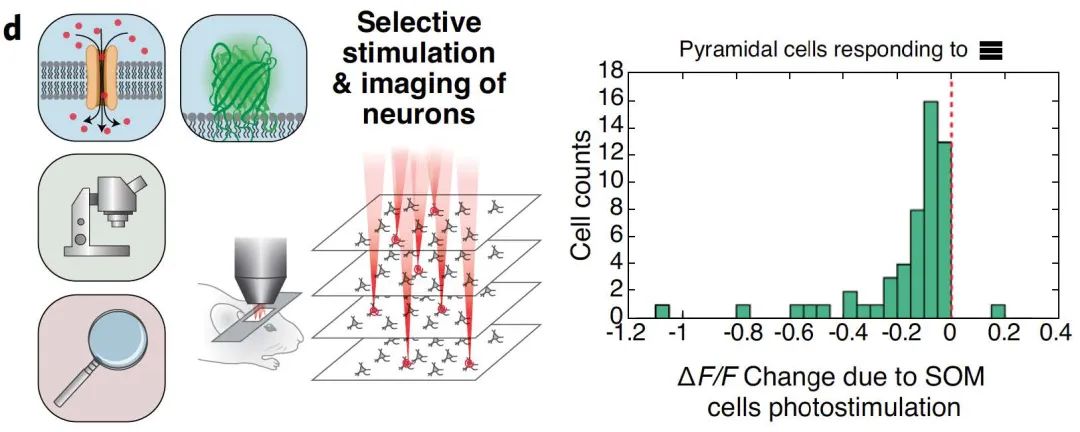
图10 | 小型化系统对钙离子变化的监测
3►
药理学平台
基于纳米和微流体技术的发展,程序性药物递送成为可能。最新的系统可支持多种药物的定时定量注射,并允许动物自由活动。例如⼀个薄硅柄上搭载五个微流体通道用于脑深部药理刺激(图 4a)。当与头戴式系统集成时,管道连接到外部流体管理系统,这种“化学探针”可以向目标单独或同时提供三种药物。图4b展示了复合纤维型多功能微流控探针、微流体通道(~20×20 μm2),六个电极(每个~20×20 μm2,0.8 kΩ/sq 薄层电阻,2.48 Ωcm2阻抗)的集成组件。这种多功能纤维(直径 200 μm)进入大脑并通过光纤、电线和流体管连接到外部控制硬件。外部药物输注系统可控制其以60和 600 nl/min的流速输送药物。也可以将程序药理学与光遗传学相结合(图4c)。在⼀种设计中,将四个独立的药物储存器整合到薄而灵活的硅胶探头。低弯曲刚度有利于贴合到⼤脑表⾯或外周神经元,同时在同⼀位置植入μ-ILED (100×100×6.54 μm3)探针的尖端,可进行光遗传学调控。
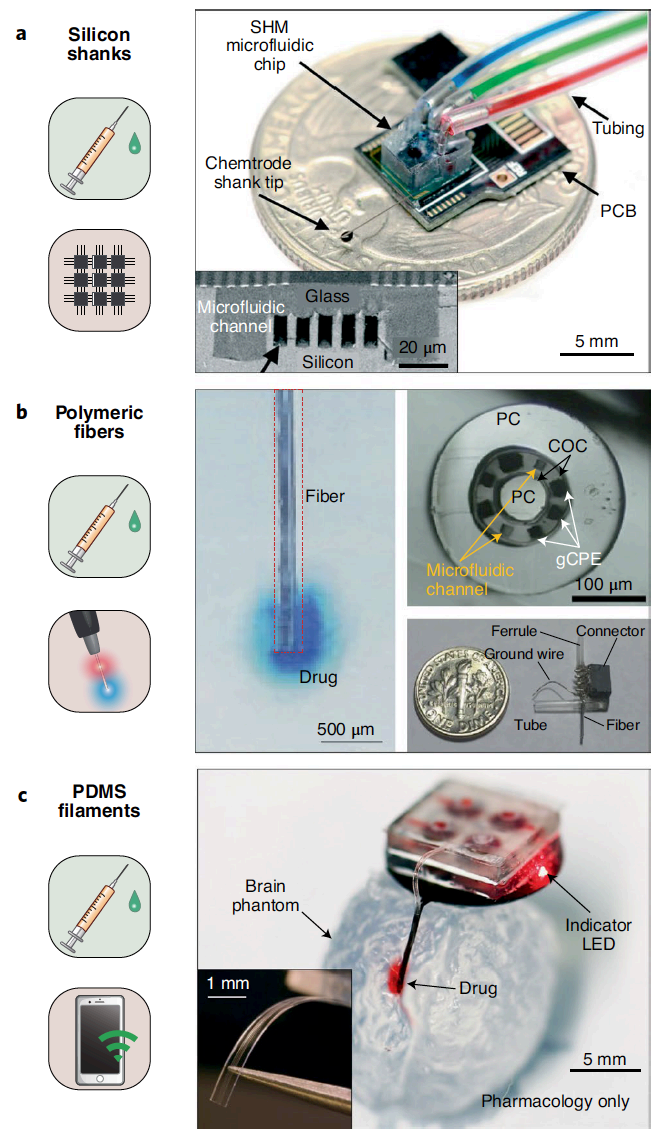
图11 | 用于药理学和其他神经调节功能的神经接口
已有研究利用硅柄的微流控药物输送平台,观察麻醉小鼠海马CA1和CA3区域的相互作用。在CA1和CA3区域插入四个探针(S1、S2、S3 和 S4)用于电生理记录,其中⼀个在CA3中用于药理学传递和光遗传学刺激。四个探针的电生理记录显示,AMPA受体拮抗剂CNQX和NMDA受体拮抗剂AP5能抑制由光刺激引起的从CA3到CA1的神经元放电。
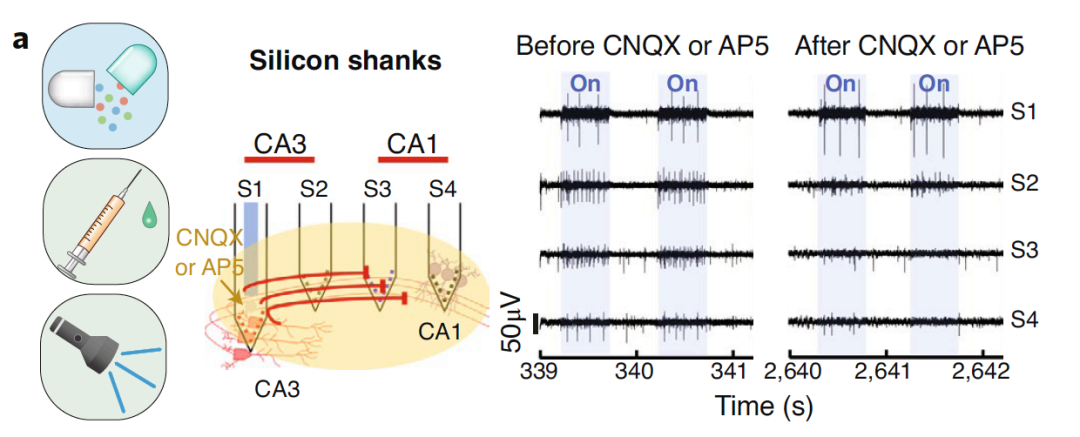
图12 | 微流控药物输送平台观察不同脑区的相互作用
另⼀项研究显示,在用ChR2转染的小鼠中,光刺激LH可诱导实时位置偏好 (RTPP) 行为,这一行为受到GABA受体抑制剂的抑制。左图:安装在鼠标头上的设备示意图。右图:在光刺激期间gabazine递送前后的运动基线的热图。
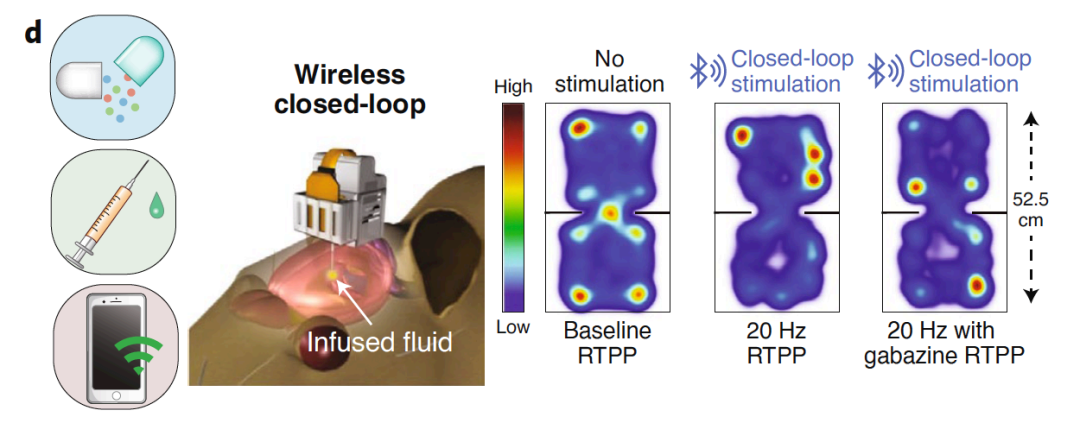
图13 | 微设备监测RTPP行为
4►
电化学和光学传感的新方法
传统的荧光方法依赖于荧光蛋白的荧光基团,基于荧光共振能力转移FRET机制。大多数FP包括一个刚性保护发色团的蛋白质结构,能与目标受体结合,受体通常远离发⾊团。这些特征限制了目标蛋白的动态监测。例如,钙探针Yellow Cameleon 6.1的动态范围约为200%,结合靶标时的解离常数(Kd)约为110 nM,典型的响应时间(秒)比发生的生理相关钙瞬变(毫秒级)慢得多。cpFPs可克服这些挑战。cpPF的受体存在于FP的一级结构中,通常靠近发色团而不损害固有的荧光特性。因此,将目标分析物与cpFP结合会使荧光水平发生较大改变,其速度快于基于FRET的方法所能达到的速度。与基于FRET的系统相比,钙选择性GCAMP6f提供 >1,300%的动态范围、~375 nM的解离曲线和更快的响应时间,接近自然发生瞬态的时间尺度。
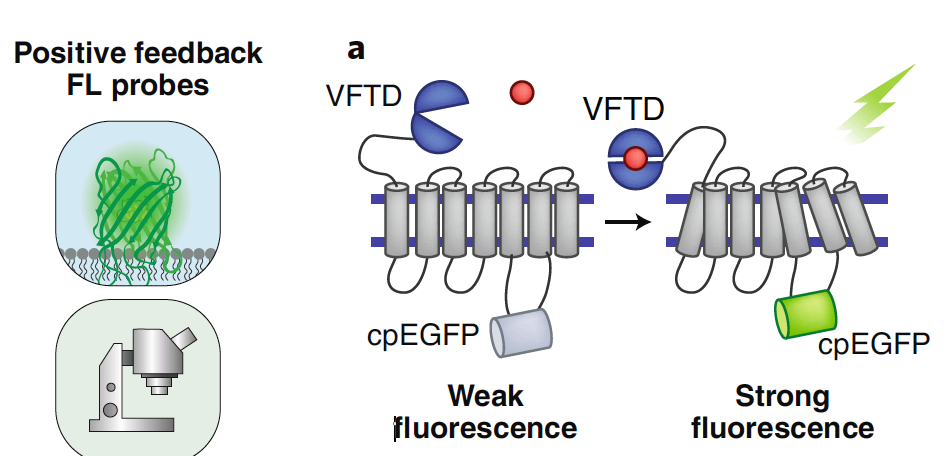
图14 | cpFPs的应用
电化学(EC)传感器的开发也有新的进展。传统方法依赖于束缚碳微电极和电分析技术来监测相对少量的神经化学物质。最近的一篇论文描述了一种用于同时进行光遗传学和多巴胺传感的双功能无线微针。用于EC传感器的适体通常包括连接到 3'-磷酸基团的氧化还原部分和位于5'-磷酸基团的硫醇接头。目标的结合改变了氧化还原部分和传感器电极之间的距离,以产生与浓度成正比的电流。
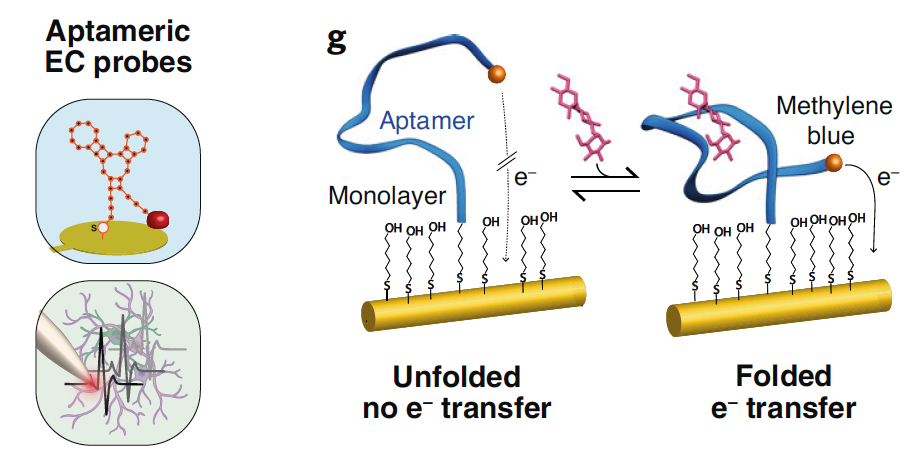
图15 | EC传感器的应用
总 结
于神经科学研究而言,神经细胞、网络的监测与调控技术尤为重要。随着材料科学、生物工程、光学、电学的发展,为神经科学研究的技术提供了更为丰富的平台。这些平台以可在体植入的形式,用于光遗传学、光学测定、血氧测定、药物输送、温度监测,甚至用于测量微血管和大血管血流。
