时间:2022-06-06 10:28
腺相关病毒(adeno-associated virus, AAV)是一类无法自主复制、无被膜的二十面体微小病毒,直径约20-26nm,由长度为4.7kb左右的线状单链DNA作为基因组,目前尚无引起人类疾病的报道。
研究人员通过工程化的衣壳蛋白和基因组相组合,利用特定基因调控元件来控制转基因表达,开发出新型重组AAV载体。rAAV具备种类多样、免疫原性极低、安全性高、宿主细胞范围广、扩散能力强、体内表达基因时间长等优点,现已经成为神经科学研究中最常用的工具之一。随着神经科学的不断发展,如何将AAV特异性靶向至大脑不同类型的细胞,成为了日益关注的焦点。
最新发表于Annual Review of Neuroscience的一篇题为Adeno-Associated Virus Toolkit to Target Diverse Brain Cells的综述文章,将聚焦于特定靶向于不同脑细胞的AAV工具,并以下5个方面讨论:①如何通过工程化改造AAV衣壳实现微创地靶向大脑,②AAV在小鼠和灵长类动物模型中的应用,③改造AAV的基因组元件实现靶向大脑,④AAV的安全性和有效性,⑤对基因治疗和基因编辑提出美好愿景。
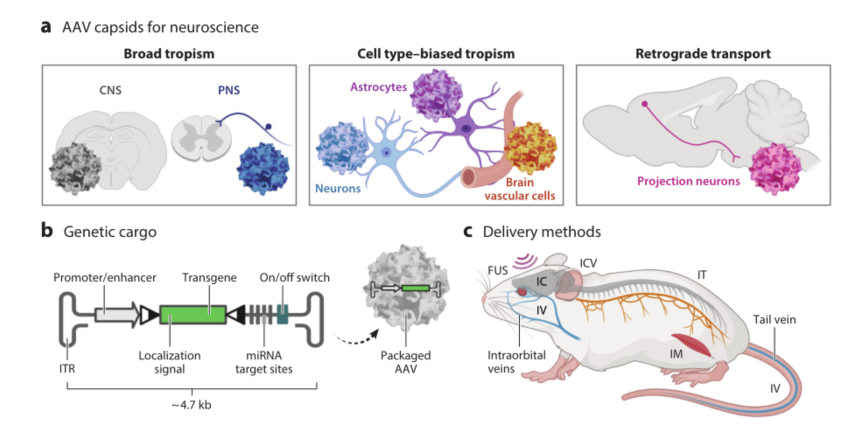
图1. 用于将基因靶向递送至大脑的AAV工具
工程化改造AAV衣壳实现靶向大脑的设计策略
许多天然的AAV载体可以通过颅内注射后广泛地转导大脑中的神经元和胶质细胞。一部分AAV载体(如AAV9血清型等)也可以通过静脉注射后跨过血脑屏障(BBB)转导脑细胞。但这两种策略都有明显的不足之处:颅内注射是一种侵入式手术,病毒从注射部位扩散,易产生转基因表达的空间梯度差异,难以覆盖很大的范围和分散的脑区;而静脉注射需要很高的病毒剂量,易导致外周器官的转导,具有潜在的肝毒性。
为了实现人类基因治疗的最终目标,工程化设计rAAV已成为研究热点。这些研究通过细胞培养和体内多轮筛选来获取不同的衣壳蛋白,使之具备以下优势:1.可靶向特定的细胞类型,如靶向内皮细胞(点击查看AAV-BI30血清型详情)、星形胶质细胞(点击查看AAV-11血清型详情);2. 最大限度提高转基因能力(点击查看策略详情);3.尽可能降低免疫排斥反应;4.通过将非靶向吸收转移到靶向细胞,减少病毒注射剂量。
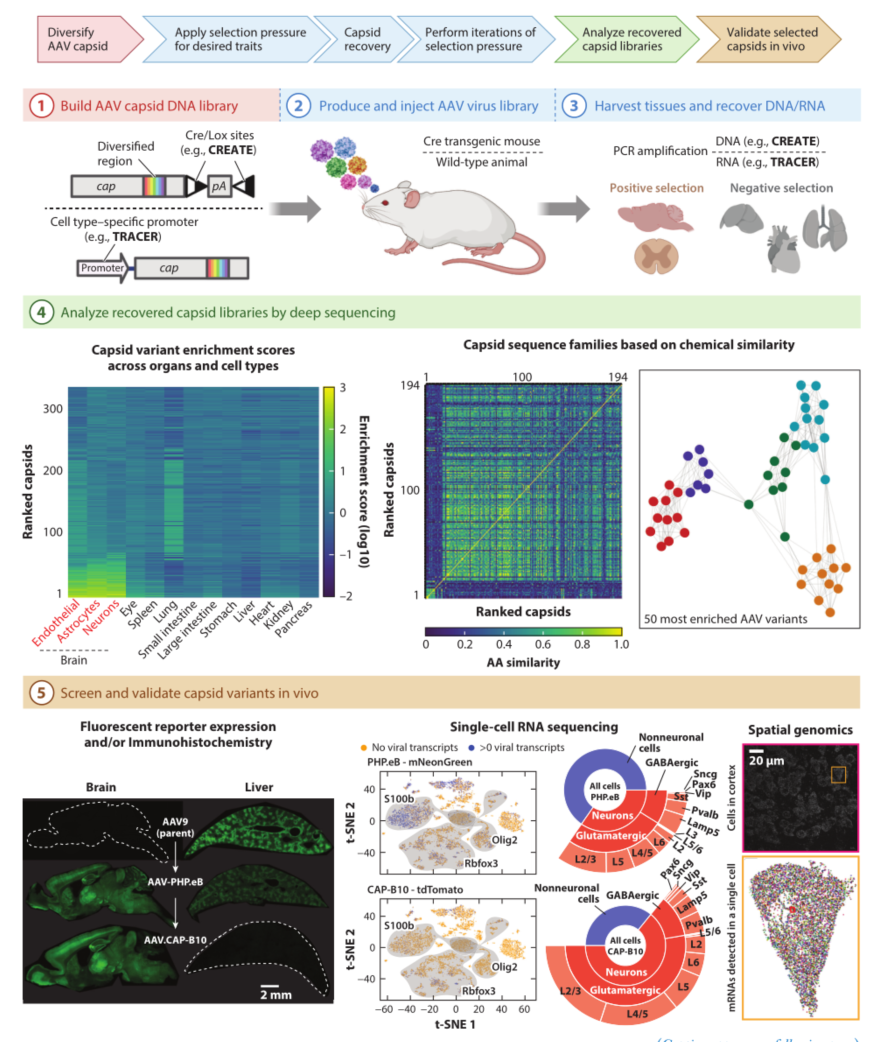
图2. 靶向大脑的工程化AAV载体设计策略
AAV在不同动物模型中的应用
为实现基因递送和基因治疗研究的更广泛应用,新开发的AAV载体和递送物必须在不同模式生物和不同遗传背景下发挥作用。已有研究证实小鼠的遗传背景会影响AAV在脑内的转导特性。同时,不同的衣壳蛋白变体具有不同的穿透血脑屏障的机制,如CAP.B10、PHP.eB、9等血清型可以穿越BBB(点击蓝字查看详情)。通过免疫组化或高通量衣壳分析方法对各种AAV血清型在不同遗传背景下小鼠跨血脑屏障的能力进行鉴定,有助于揭示这种差异背后的分子机制。除了遗传背景的影响外,年龄和性别等生物学因素也会影响AAV在小鼠的转导特性。
目前已经有不少研究在小鼠模型中成功使用AAV病毒载体进行基因治疗,且具有良好的治疗活性和长期安全性,那么基于小鼠模型设计的AAV载体能否应用于灵长类物种(点击查看详情)呢?由于物种间的差异性,在评估新的工程化AAV时,仍需保持谨慎态度,在非人灵长类动物中进行长期观察,以保证最终人类基因治疗的安全性和可靠性。
改造AAV的基因组元件实现靶向大脑的设计策略
AAV的靶向特异性也可以通过改造AAV的基因调控元件来实现,如启动子、增强子和miRNA实现转基因特异性。
●启动子:可以驱动AAV在不同类型脑细胞中表达,包括神经元、胶质细胞(点击查看GfaABC1D启动子详情)和血管内皮细胞。可以用不同启动子实现在不同神经细胞中的特异性表达,如5-羟色胺能细胞、小脑浦肯野细胞、小清蛋白阳性GABA能中间神经元等。
●增强子(调节转录的短基因组区域):也可以驱动AAV载体的转基因表达。增强子与启动子结合可实现跨物种的脑区和神经细胞特异性标记。例如,mDlx增强子可限制基因在斑马雀、啮齿动物、非人灵长类动物前脑GABA能中间神经元和人类细胞中的特异性表达,并可以在通过AAV-PHP.eB载体静脉注射到小鼠体内时保持脑区和细胞类型特异性。
●miRNA:是一类约21-23个核苷酸的非编码RNA,由细胞内源产生的发卡结构转录本加工而来。miRNA通过合与mRNA 3’UTR上互补的靶序列结合,从而抑制mRNA的表达。当与强启动子连用时,可以在靶细胞中驱动高水平的转基因表达。例如,AAV-PHP.eB通过将 miRNA 靶位点整合到其基因组中,特异性递送目标转基因表达给神经元或星形胶质细胞。miRNA介导的通过APC去靶向(detargeting)调节转基因表达已显示出降低转基因相关的毒性和免疫反应。通过提高miRNA介导的detargeting效率,降低AAV转基因的免疫原性,有助于开发更安全、更有效的AAV基因治疗递送载体。目前已鉴定出数百种miRNA。然而,它们单独或组合对组织和细胞类型特异性的影响尚未确定。未来需要继续验证 miRNA的靶位点来更好地将转基因表达限制在指定的脑区和脑细胞中。
随着技术的发展,除研究如何在目标位点诱导基因表达的同时,研究者也开始通过光遗传或化学遗传学等技术手段来实现转基因表达的时空调控。新型转录表达控制系统的开发将允许对转基因(包括治疗基因)进行精确和有条件的调节,以提高 AAV 递送疗法在基础和转化研究中的安全性和有效性。
展望—— 基因治疗与基因编辑
AAV载体一直被视作基因治疗的有效工具。近年来,基因治疗在代谢、血液和神经肌肉疾病等方面均取得了显著的成效。美国食品药品监督管理局已经批准Luxturna用于治疗RPE65相关性视网膜营养不良和Zolgensma用于治疗脊髓性肌萎缩症,表明基于AAV的疗法在中枢神经系统疾病中的有效性。随着研究的不断深入,须了解基因治疗的毒理性研究,包括其潜在毒性和免疫反应的机制,为未来的临床治疗提供依据。AAV引起的毒性可在病毒注射后数天至数周发生,并在啮齿动物和非人灵长类动物中持续数月。因此,在临床前研究中需要延长观测时间点,以预测和减轻患者可能出现的并发症。在解决毒性相关问题的同时,还需要注意改进病毒扩散和特异性等,以进一步促进针对脑疾病的基因治疗工具的发展。本文提供了针对脑疾病的基因治疗优化策略,例如特定脑区的嗜性、靶向进入与疾病相关的特定细胞类型和组织微环境、降低安全性和耐受性的风险 (例如,免疫原性和毒性),以及提高疗效等。
除了AAV载体本身的进步,基因编辑工具在过去数年间也取得了长足的进步,尽管仍然存在一些不确定性,但无疑为我们进一步了解疾病中的基因功能和确定潜在的治疗靶点提供了新的可能性。开放性科研平台如Addgene’s AAV Data Hub (https://datahub.addgene.org/aav/)的应用可以帮助研究人员发现和共享AAV数据,以加快生物医学研究。近年来,用于神经科学研究的AAV载体发展迅速,通过扩展AAV工具的可用性和易用性,研究人员可以更加轻松地使用工程化AAV实现跨物种、微创、特异性的基因表达。
上述产品/服务布林凯斯均可提供
快来咨询我们吧!
本文未经授权禁止转载
如有需要,可联系小编获取原文
